La destilación es la operación de separar, mediante evaporización y condensación, los diferentes componentes líquidos, sólidos disueltos en líquidos o gases licuados de una mezcla, aprovechando los diferentes puntos de ebullición (temperaturas de ebullición) de cada una de las sustancias ya que el punto de ebullición es una propiedad intensiva de cada sustancia, es decir, no varia en función de la masa o el volumen, aunque sí en función de la presión.
Fisico-qui Fisico-qui Fisico Química
Wanda Tesar y Marina Campos
martes, 13 de septiembre de 2011
martes, 6 de septiembre de 2011
Las mezclas homogeneas y heterogeneas
Mezclas homogéneas:
Las mezclas homogéneas están formadas por una sola fase, es decir, no se pueden distinguir las partes, ni aún con la ayuda de un microscopio electrónico ordinario, presenta la misma composición en cualquiera de sus partes.
Mezclas heterogéneas:
Las mezclas heterogéneas son mezclas con una composición no uniforme, está formada por dos o mas fases fisicamente distintas y distribuidas en forma desigual. Las partes de una composición heterogénea pueden ser separadas mecánicamente unas de otras. Algunos ejemplos incluyen a las ensaladas, arena, sal mezclada con arena, y el suelo.
Las mezclas homogéneas están formadas por una sola fase, es decir, no se pueden distinguir las partes, ni aún con la ayuda de un microscopio electrónico ordinario, presenta la misma composición en cualquiera de sus partes.
Mezclas heterogéneas:
Las mezclas heterogéneas son mezclas con una composición no uniforme, está formada por dos o mas fases fisicamente distintas y distribuidas en forma desigual. Las partes de una composición heterogénea pueden ser separadas mecánicamente unas de otras. Algunos ejemplos incluyen a las ensaladas, arena, sal mezclada con arena, y el suelo.
Solvente y Soluto
SOLUTO:
Se llama soluto a la sustancia minoritaria (aunque existen excepciones) en una disolución o, en general, a la sustancia de interés.
Lo más habitual es que se trate de un sólido que es contenido en una solución líquida (sin que se forme una segunda fase)
La solubilidad de un compuesto químico depende en gran medida de su polaridad. En general, los compuestos iónicos y moleculares polares son solubles en disolventes polares como el agua o el etanol; y los compuestos moleculares apolares en disolventes apolares como el hexano, el éter o el tetracloruro de carbono
SOLVENTE:
aquella sustancia que permite la dispersión de otra en su seno. Es el medio dispersante de la disolución. Normalmente, el disolvente establece el estado físico de la disolución, por lo que se dice que el disolvente es el componente de una disolución que está en el mismo estado físico que la disolución. También es el componente de la mezcla que se encuentra en mayor proporción.
Las moléculas de disolvente ejercen su acción al interaccionar con las de soluto y rodearlas. Se conoce como solvatación. Solutos polares serán disueltos por disolventes polares al establecerse interacciones electrostáticas entre los dipolos. Los solutos apolares disuelven las sustancias apolares por interacciones entre dipolos inducidos.
Se llama soluto a la sustancia minoritaria (aunque existen excepciones) en una disolución o, en general, a la sustancia de interés.
Lo más habitual es que se trate de un sólido que es contenido en una solución líquida (sin que se forme una segunda fase)
La solubilidad de un compuesto químico depende en gran medida de su polaridad. En general, los compuestos iónicos y moleculares polares son solubles en disolventes polares como el agua o el etanol; y los compuestos moleculares apolares en disolventes apolares como el hexano, el éter o el tetracloruro de carbono
SOLVENTE:
aquella sustancia que permite la dispersión de otra en su seno. Es el medio dispersante de la disolución. Normalmente, el disolvente establece el estado físico de la disolución, por lo que se dice que el disolvente es el componente de una disolución que está en el mismo estado físico que la disolución. También es el componente de la mezcla que se encuentra en mayor proporción.
Las moléculas de disolvente ejercen su acción al interaccionar con las de soluto y rodearlas. Se conoce como solvatación. Solutos polares serán disueltos por disolventes polares al establecerse interacciones electrostáticas entre los dipolos. Los solutos apolares disuelven las sustancias apolares por interacciones entre dipolos inducidos.
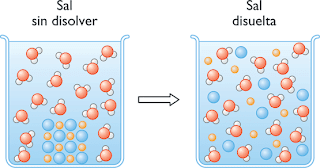
La concentracion
la concentración de una disolución es la proporción o relación que hay entre la cantidad de soluto y la cantidad de disolvente, donde el soluto es la sustancia que se disuelve, el disolvente la sustancia que disuelve al soluto, y la disolución es el resultado de la mezcla homogénea de las dos anteriores. A menor proporción de soluto disuelto en el disolvente, menos concentrada está la disolución, y a mayor proporción más concentrada ésta.
Las Soluciones
Una solución es una mezcla homogénea de dos o mas sustancias. La sustancia disuelta se denomina soluto y esta presente generalmente en pequeña cantidad en pequeña cantidad en comparación con la sustancia donde se disuelve denominada solvente. La concentración de una solución expresa la relación de la cantidad de soluto a la cantidad de solvente.
martes, 30 de agosto de 2011
Modelo Cinetico Molecular de la materia
Estado sólido:
Predominan las fuerzas de cohesión sobre las de repulsión.
Las partículas sólo pueden vibrar alrededor de su posición de equilibrio.
Estado líquido:
Las fuerzas de cohesión y de repulsión son del mismo orden.
Las partículas pueden desplazarse con cierta libertad pero sin alejarse unas de otras.
Por esa razón los líquidos tienen volumen constante y se adaptan a la forma del recipiente.
Estado gaseoso:
Predominan las fuerzas de repulsión sobre las de cohesión.
Las partículas se mueven con total libertad y están muy alejadas unas de otras. Por eso los gases tienen forma variable y tienden a ocupar todo el volumen disponible.
Predominan las fuerzas de cohesión sobre las de repulsión.
Las partículas sólo pueden vibrar alrededor de su posición de equilibrio.
Estado líquido:
Las fuerzas de cohesión y de repulsión son del mismo orden.
Las partículas pueden desplazarse con cierta libertad pero sin alejarse unas de otras.
Por esa razón los líquidos tienen volumen constante y se adaptan a la forma del recipiente.
Estado gaseoso:
Predominan las fuerzas de repulsión sobre las de cohesión.
Las partículas se mueven con total libertad y están muy alejadas unas de otras. Por eso los gases tienen forma variable y tienden a ocupar todo el volumen disponible.
Suscribirse a:
Entradas (Atom)